摘要
基于石墨烯的二维纳米材料在能量存储系统,特别是在超级电容器中获得了很大的兴趣。各种电解质提高了超级电容器(UC)、锂离子电容器(LIC)和锂离子电池(LIB)的性能。在目前的工作中,我们已经成功地设计了一种“三合一”的人工方法,从单一前驱体中设计高性能UC, LIC和LIB的阳极。在本研究中,使用改进的Hummers方法开发了氧化石墨烯(GO)浆料。考察了KOH、H2SO4和KCl电解质对UC电化学性能的影响。研究了LiPF6有机电解质溶液对LIC和LIB电化学性能的影响。氧化石墨烯沉积在不锈钢电极上,其最高比电容为422 F/g,能量密度为45.50 kWh/kg,在3.0 M KCl中功率密度为10,000 W/kg,而氧化石墨烯作为阳极材料,在0.05 a /g电流密度下首次放电容量为456 mAh/g,效率为100%。
1 介绍
随着零排放可充电汽车、汽油车、电动汽车(也称为混合电动汽车(MEAs))、可移动电子产品市场的迅速发展,对大功率、能量密度高、循环寿命长的环保型储能系统的需求不断增加。超级电容器(UC)又称超级电容器(SC),在储能系统中有着广泛的应用[1]。
根据电荷存储机制的不同,超级电容器可分为双电层电容器(edlc)、伪电容器(pseudocapacitor)和混合电容器(hybrid capacitor)。假电容器和edlc依赖于正极和阳极材料的性质来同时工作。在UCs中,使用新型纳米电极材料的技术不断发展。文献揭示了UC器件、阳极和阴极材料的新创新思路、科学方面和技术[1,2,3,4,5,6]。为了保证UC中储能容量和功率分配率的良好执行时间持续时间,以及电极和水、非水电解质的合适孔径和比电极表面积,高能电容器的发明和发展至关重要[1,2,3,4,5,6]。
目前,锂离子电容器(LIC)是众多最先进的电源库之一,架起了SC和LIB器件之间的桥梁。该LIC由三种材料组成(i)阴极材料及其电容型,(ii)阳极材料及其电池型;(iii)含锂盐的有机电解质溶液具有较宽的功能窗口[7][7]。
高性能集成电路具有高功率和高能量密度的特性。正极材料与负极材料组合使用时容量差,降低了锂离子电池的能量密度。使用特殊仓库工具的阳极包括插入、转换和合金类型。如Li4Ti5O12 (LTO)[10]和石墨[9]属于插入型负极材料,具有足够的循环稳定性。然而,它的窄比势降低了LIC的能量密度。另一方面,转换型阳极如氧化锰(MnO)、氧化铁(Fe2O3)和合金型阳极如锂化阳极锡(Sn)和硅(Si)材料提供了良好的比容量。就正极材料而言,LIC具有edlc型电荷存储系统。在LIC器件中,离子在电极和电解质之间的界面表面积聚。电荷物理地存储在电极的外部,导致较差的比电容和比容量。阴极材料的LIC比电容可因不同分子以掺杂形式的电化学运动而得到富集[11]。
由于出色的环境兼容性、高能量密度、低自放电和总能量循环率,锂离子电池(lib)是全球范围内储能的通用工具。lib在耳机、笔记本电脑、手机、ipod、智能手表以及现在的零排放电动汽车中都有大量的应用[12,13,14,15]。目前,锂离子电池要求高容量、长循环寿命、轻重量和灵活设计。传统的锂离子电池使用石墨材料,因为它的理论比容量和增加的电流密度保持[16,17,18,19]。碳基材料因其优异的物理和电化学性能而广泛应用于锂离子电池中作为阳极[20]。
氧化石墨烯(GO)的导电负极材料也比石墨(G)具有更高的锂储量,并且在水中具有出色的化学稳定性和分散性。同样,氧化石墨烯的合成工艺可行且简单,成本远低于石墨烯。氧化石墨烯具有较高的容量和优良的长生命周期性能,并能快速形成自己的合成有机粘结剂组装层/片,其具有羟基、环氧化物、羰基等多种活性基团,即OH、C - O - C、C=O。其他活性基团包括sp2杂化、羧酸、苯酚,即C=C、COOH、C6H5OH。然而,并不是所有的官能团都能积极影响电化学性能;有些会产生不良后果,例如永久性高锂离子摄入量[21,22,23,24,25,26,27,28,29]。
氧化石墨烯,有时称为氧化石墨烯,是用含有氯酸钾(KClO3)和硝酸(HNO3)的氧化混合物处理锡兰石墨烯合成的[30]。最近,Staudenmaier-Hoffman-Hamdi技术将浓缩的H2SO4、HNO3和石墨加入KClO3中,并在一周的时间内逐渐混合在KClO3中冷却制备的混合物。二氧化氯与惰性气体(如氮气或二氧化碳)一起释放。该方法每处理克石墨需要10克以上的氯酸钾,爆发是一个持续的危险[30]。
在本研究中,我们采用改进的Hummer方法合成了氧化石墨烯,并研究了不同电解质对氧化石墨烯基UC、LIC和LIB电池性能的影响。
2 实验的细节
2.1 材料
石墨片(GF)购自Sigma-Aldrich,粒径为+ 100目(≥75% min)。此外,硝酸钠(NaNO3)、硫酸(H2SO4)、高锰酸钾(KMnO4)、30%过氧化氢(H2O2)和盐酸(HCl)购自Thomas Baker。
2.2 氧化石墨烯的合成
氧化石墨烯的合成采用略微改进的Hummers方法[30]。将5 gm GF、2.5 gm NaNO3和120 mL H2SO4加入500 mL冰浴锥形烧瓶中。然后缓慢加入15gm的KMnO4,使温度保持在20℃以下。在室温下磁力搅拌24h。随着搅拌时间的增加,混合物变成糊状,混合物的颜色变成浅棕色。搅拌32 h后,加入150ml水。浆糊的颜色变成了黄色。当混合物变黄时,加入50 ml 30% H2O2。再搅拌15分钟,最后加入蒸馏水净化氧化石墨烯。所得混合物在玻璃罐中提取(2000 mL)。将混合物冷却并离心后变成褐色浆料,用于进一步表征。
2.3 材料表征
材料的纯度和结晶度采用x射线衍射仪(XRD)进行了鉴定,其CuKα (λ = 1.54184 Å)辐射范围为2θ(10°~ 80°)。利用拉曼显微镜(Renishaw inViaTM,激光激发波长为532 nm)在50 ~ 3000 cm−1的频率范围内获得样品的拉曼光谱。利用Nova NanoSEM NPEP303的场发射扫描电镜(FE-SEM)和能量色散x射线能谱(EDX)对其表面形貌、尺寸和元素图进行了分析。表面研究在JASCO ftir6100仪器上进行。使用Holmarc OptoMechatronics Pvt. Ltd.的HO-IAD-CAM-01接触角计测量氧化石墨烯电极的接触角。印度)。
2.4 电化学表征
在3.0 M KOH, 0.5 M H2SO4, 3.0 M KCl电解质溶液中,采用三电极(3E电池)对氧化石墨烯基UC进行电化学测量。在这里,氧化石墨烯是工作电极(~ 1 × 1 cm2),铂(Pt)板(2 cm × 2 cm)作为计数器,饱和甘汞(SC)作为参比电极。将氧化石墨烯与n -甲基-2-吡咯烷酮(NMP)中的聚偏氟乙烯结合剂(PVDF)以90:10的质量比混合制备工作电极。然后,将上述材料(0.0002 gm)涂覆在1 cm × 1 cm的不锈钢(SS)衬底上,在实验室烤箱中45°C烘干24 h。对于UC,电化学分析使用ZIVE MP1多通道电化学工作站仪进行。进一步计算氧化石墨烯电极的比电容(Cs)、能量密度(ED)和功率密度(PD),公式如下[31]。
(1) (2) (3)其中“m”为工作电极上沉积材料的质量。s为扫描速率;是CV分析的潜在窗口。“I”是当前的反应。dT为放电时间,Vmax和Vmin为最大和最小电位。
并对不同的电化学参数进行了评价;其中,“是”能量密度和“是”功率密度分别按公式(4)和式(5)计算[32]。
(4) (5)采用循环伏安法(CV)和恒流充放电(GCD)试验研究了氧化石墨烯(GO)工作电极在3种不同电解质溶液(3.0 M KOH、0.5 M H2SO4和3.0 M KCl)中的电化学性能。对于KOH电解质,CV测量在- 1.2至0.0 V/SCE的电位窗口内进行,稳定电位窗口为- 0.4至0.4 V/SCE。GCD测量在−1.2至−0.8 V/SCE的电位窗口内进行。对于H2SO4电解质,CV测量在−0.4至0.0 V/SCE的电位窗口内进行。对于KCl电解质,CV测量在−1.0至0.0 V/SCE的电位窗口内进行。最后,对于LiPF6电解质,LIC和LIB研究的GCD研究在0.0 V至3.0 V (vs Li/Li+)的电位窗口内进行。这些测试有助于评估氧化石墨烯工作电极在不同电解质溶液中的电化学行为,并提供有关其电化学性能和稳定性的重要信息。半硬币电池氧化石墨烯阳极示意图如图1所示。
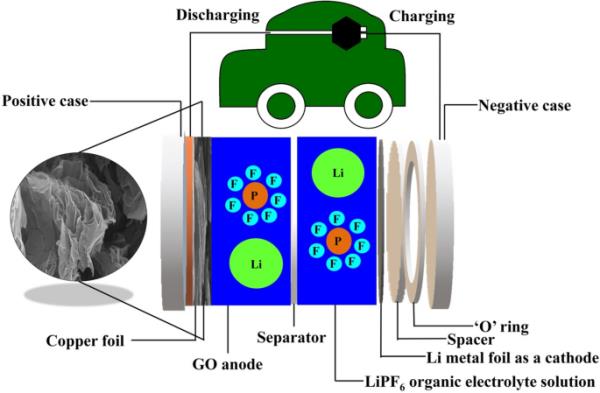
半硬币电池氧化石墨烯阳极图形摘要
目录
摘要1 介绍
2 实验的细节
3.结果与讨论
4 结论
参考文献
致谢
作者信息
搜索
导航
#####
3.结果与讨论
3.1 结构分析
GO电极的XRD谱图如图2所示。与(001)平面相关的10.71°衍射峰对应于纯GO相[30]。氧化石墨烯的晶粒尺寸采用式(6)所示的Scherrer公式计算[33]。
(6)式中“D”为氧化石墨烯的晶粒尺寸。' 0.9 '是舍勒常数。λ是x射线束的波长。' β '为平面(001)的半最大宽度(FWHM)。θ是布拉格角。
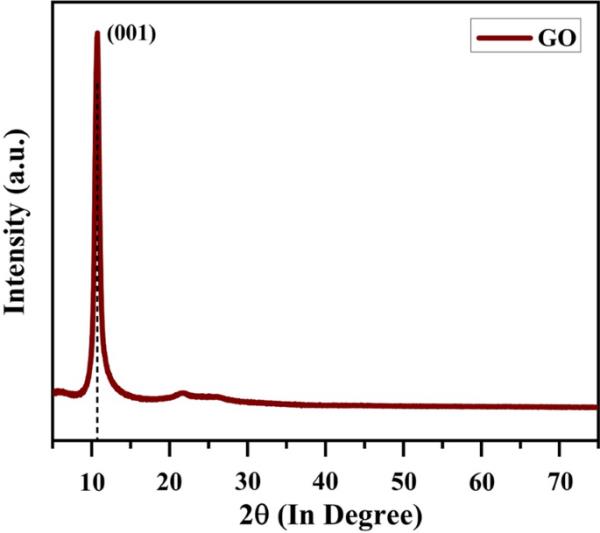
氧化石墨烯电极的x射线衍射图
计算得到的晶体尺寸为11.8 nm。
3.2 傅里叶变换红外光谱(FTIR)分析
氧化石墨烯阳极在400-4000 cm−1波数范围内的FTIR光谱如图3所示。光谱显示在1079 cm−1处存在C - O拉伸振动信号,在1192 cm−1处存在环氧活性基团C - O - C拉伸振动信号,在1376 cm−1处存在酚类C - OH酚类OH拉伸振动信号,在1864 cm−1处存在羧基活性基团C=O拉伸信号。此外,表1给出了氧化石墨烯的波数、峰源和振动类型[34]。
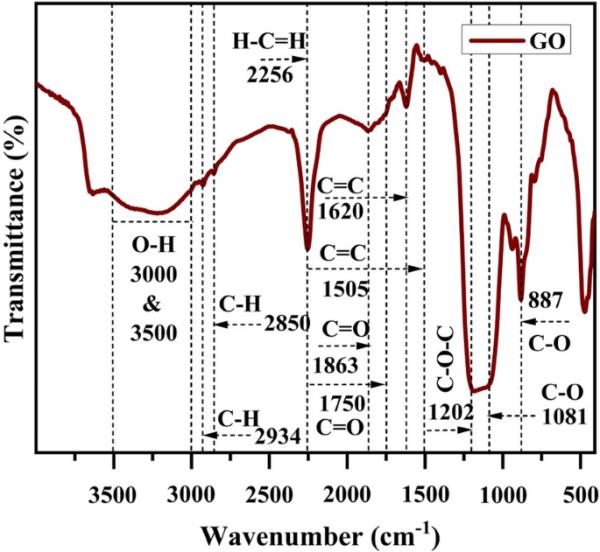
氧化石墨烯电极的傅里叶变换红外光谱
3.3 可湿性分析
在润湿性分析中,液体和蒸汽的界面与H2O的液固界面之间形成一个接触角[35]。因此,为了控制或修饰工作电极表面,润湿性是UC储能的主要特性[35]。GO电极的H2O接触角测量图像如图4所示。石墨烯电极的接触角为71.6°。润湿性分析表明,氧化石墨烯电极具有亲水性,适用于UC, LIC和LIB应用。
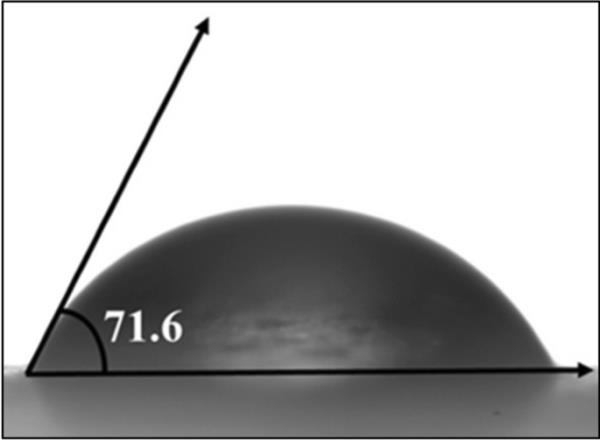
GO电极接触角
3.4 拉曼光谱分析
利用拉曼光谱分析了氧化石墨烯样品的结构。图5显示了氧化石墨烯的拉曼光谱。1350和1590 cm−1处的特征峰分别代表GO的D和G波段[37]。在氧化石墨烯中,它表示氧化石墨烯薄片没有减少[36]。
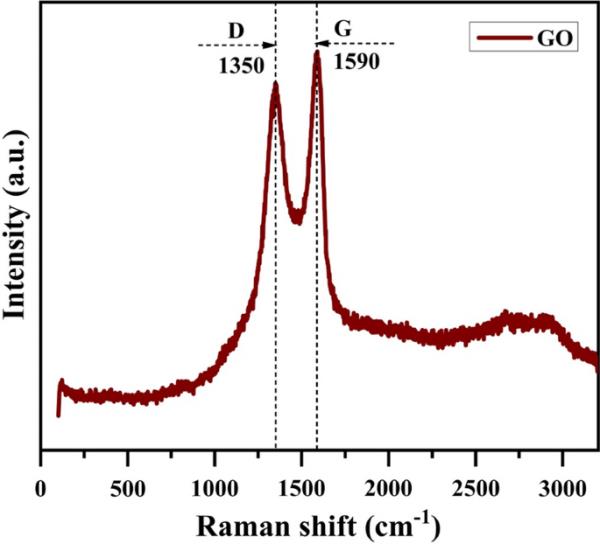
氧化石墨烯电极的拉曼光谱
3.5 形态分析
场发射扫描电镜(FE-SEM)研究的颗粒尺寸和样品表面形貌如图6(a-c)所示。氧化石墨烯的形态包括各种尺寸,其表现为褶皱和波纹片状形式,这可能是由于剥离和重新堆积过程中的变形引起的[37,38,39]。在100KX放大下,网络的孔径在几µm范围内,可以清晰地看到5 nm厚度的壁。

不同倍率(a) 1KX, (b) 10KX和100KX下氧化石墨烯薄膜的FE-SEM图像
3.6 能量色散x射线光谱(EDX)分析
图7(a)显示了氧化石墨烯样品的EDX分析。只有碳(C)和氧(O)含量,从而保证了氧化石墨烯的合成。在高碳(C)含量为74.18%、高氧(O)含量为25.82%时,可观察到氧化石墨烯。
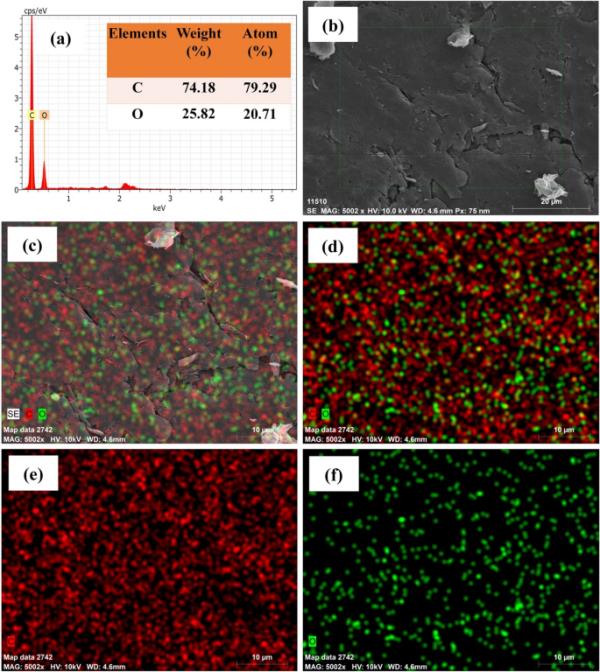
(a)元素组成(%)和原子(%)的EDX图,(b)氧化石墨烯阳极电极的选定部分,(c) c和O的SE像,(d) c和O的元素,(e) c, (f) O
3.7 电化学分析
KOH、H2SO4和KCl水溶液具有高达1 S/cm的显著导电性以及高介电稳定性[40]。水溶液电解质的离子浓度比有机电解质高,电阻也较低。在能量库策略中存储电荷的能力依赖于离子对其海绵状结构区域的渗透性,因此其离子尺寸和孔隙尺寸必须是最佳的。孔径的分布取决于其所含电解质中离子的大小,因此电极和电解质的选择必须同时进行,这样离子才能快速运动[41]。采用水电解质的UC具有比有机电解质更高的容量和功率。水电解质的另一个重要优点是,它们可以在露天生产,比有机电解质简单得多。然而,与有机电解质相比,水性电解质的缺点是电压窗口较小。由于这种限制,这些电解质表现出较低的能量和能量密度值。
3.7.1 3.0 M KOH电解液的电化学研究
图8(a)显示了在−1.2 ~ 0.0 V/SCE电位窗口中,氧化石墨烯在3.0 M KOH水溶液中扫描速率为50 ~ 200 mV/s时的循环伏安曲线。图8(b)显示了在−1.2至−0.8 V/SCE的电位窗口中,在200 mV/s扫描速率下不同周期(2 ~ 1000个周期)的CV曲线。CV曲线显示在3.0 M KOH条件下,C=O和C6H5O6基团发生了假电容性法拉第氧化还原反应。在0.002 ~ 0.004 mA/cm不同电流密度下的GCD曲线如图8(c)所示。GCD图显示了赝电容法拉第型材料的行为[42]。与C=O和C6H5O6基团的赝电容法拉迪还原氧化反应如下:
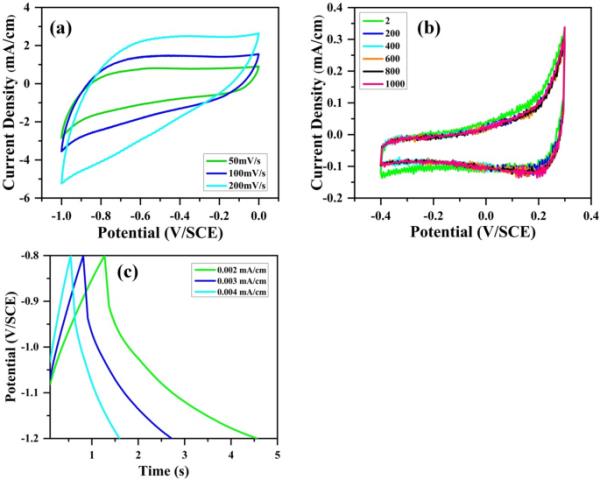
(a)添加3.0 M KOH电解质的氧化石墨烯电极在超级电容器中扫描速率为50、100、200 mV/s时的循环伏安曲线,(b)扫描速率为200 mV/s时循环2 ~ 1000次的循环伏安曲线,(c)电流密度为0.002 ~ 0.004 mA/cm时的恒流充放电曲线
(7)3.7.2章0.5 M H下的电化学研究2所以4电解液
图9(a)显示了在−0.4 ~ 0.0 V/SCE电位窗口中,氧化石墨烯在0.5 M H2SO4水溶液中扫描速率为50 ~ 200 mV/s时的循环伏安曲线。图9(b)显示了在−0.4 ~ 0.0 V/SCE电位窗口内,扫描速率为200 mV/s时不同周期(2 ~ 1000周期)的CV曲线。氧化石墨烯的CV曲线表明,在0.5 M H2SO4中,氧化石墨烯与C=O和C6H基团发生了法拉第氧化还原反应。0.003 ~ 0.004 mA/cm不同电流密度下的GCD曲线如图9(c)所示。与C=O和C6H基团的法拉第氧化还原反应如下:
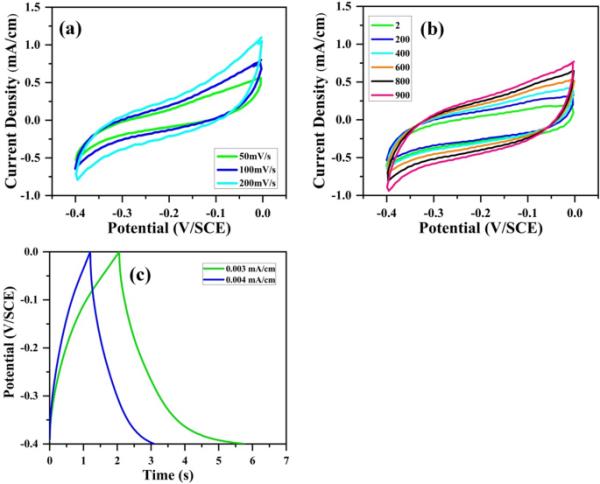
(a)含0.5 M H2SO4电解质的氧化石墨烯电极在超级电容器中扫描速率为50、100、200 mV/s时的循环伏安曲线;(b)扫描速率为200 mV/s时循环2 ~ 1000次的循环伏安曲线;(c)电流密度为0.003 ~ 0.004 mA/cm时的恒流充放电曲线
(8)在0.5、0.1、0.1 A/g电流密度下,使用0.5 M H2SO4和2 M H2SO4电解质的GO/PANI复合电极的电容分别为448、320、480 F/g[43]。在扫描速率为100 mV/s时,氧化石墨烯/聚吡咯(PPy)复合电极的电容为417 F/g[43]。
3.7.3 3.0 M KCl电解液中的电化学研究
图10(a)为1.0 ~ 0.0 V/SCE电位窗口下,氧化石墨烯在3.0 M KCl电解液中扫描速率为50 ~ 200 mV/s时的循环伏安曲线。图10(b)显示了在1.0 ~ 0.0 V/SCE电位窗口内,扫描速率为200 mV/s时,不同周期(2 ~ 1000个周期)的CV曲线。氧化石墨烯电极的C - oh、C - O - C、C=O和C6H5O6基团在3.0 M KCl中发生faradic氧化还原反应[42]。电流密度为2 ~ 4 mA/cm时的GCD曲线如图10(c)所示。氧化石墨烯的CV曲线显示氧化石墨烯的氧化还原跃迁有两个氧化还原峰,表明假电容的存在。C - oh、C - O - C、C=O和C6H5O6基团的二相氧化还原反应如下:
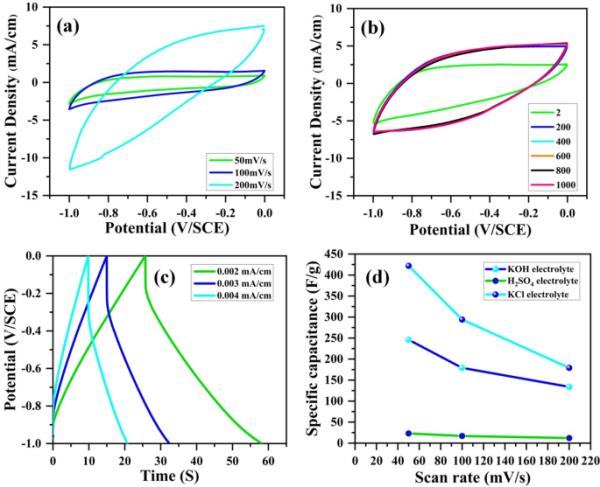
(a)添加3.0 M KCl电解质的氧化石墨烯电极在超级电容器中扫描速率为50、100和200 mV/s时的循环伏安曲线,(b)扫描速率为200 mV/s时循环2 ~ 1000次的循环伏安曲线,(c)电流密度为0.002 ~ 0.004 mA/cm时的恒流充放电曲线,以及(d)比电容与扫描速率的关系
(9)这里,在三种不同的电解质中,垂直形状的CV表现出纯电容性行为作为理想的UC。活性电极材料中电解质离子的插入/脱嵌速率取决于表面的形貌,因为它必须通过给予电解质离子足够的插入/脱嵌时间来增加活性电极材料的使用,从而提高电化学性能[25]。这三种电解质(KOH, H2SO4和KCl)由于离子尺寸较小,随着离子数量的增加,SC, PD和ED表现出不同的电容(表1)。
表2给出了样品名称、电解质、扫描速率、摩尔浓度、比电容和氧化石墨烯电极的比充放电容量。表3给出了GO电极GCD的电解质、电流密度、放电时间、电位窗口、能量密度、功率密度和充放电效率。本研究揭示了不同电解质的影响,如表4所示。
3.7.4 1 M LiPF电极制备及电化学研究6有机电解质溶液用于LIC和LIB
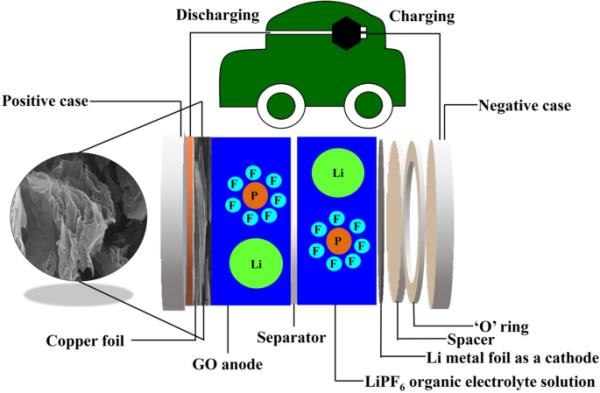
半硬币电池阳极电极以90:10的比例将浆液中的活性元素GO、聚偏氟乙烯粘合剂(PVDF)与n -甲基-2-吡罗烷酮(NMP)结合在一起。将氧化石墨烯粘稠浆料均匀涂在铜箔上,在真空烘箱中于100℃下干燥12 h。将干燥后的电极打孔在直径为16 mm、电极材料重量为0.0176 gm的圆盘上,锂金属芯片和Celgard 2400膜分别作为对电极(CE)和隔膜。用1 M LiPF6在碳酸乙酯(EC)、碳酸二甲酯(DMC)、碳酸二乙酯(DEC)(1:1:1)中作为电解质。硬币型半电池在一个充满氩气的手套箱中组装。采用NEWARE电池测试系统对电池的电化学性能进行了测试。(表5)为LiPF6有机电解质在LIB中的使用情况。
为了研究氧化石墨烯阳极电极的电化学性能,在0.0050 ~ 3.0 V电压范围内,在0.05 A/g的施加电流密度(ACD)下进行了200次循环的GCD测量。在ACD作用下,GO电极在第1 ~ 200次循环时的典型充放电曲线为0.05 A/g,如图11(A)所示。在第200次循环中,放电容量从456 mAh/g增加到74 mAh/g。锂在氧化石墨烯电极中插入和发挥时,不可避免的波纹和弯曲可能会损坏和折断颗粒[81]。图11(b)显示了在0.05 A/g条件下200次循环时库仑效率的循环次数变化。在ACD条件下,GO电极在第1 ~ 200次循环时的典型充放电效率为0.05 A/g,如图11(c)所示。GO阳极半硬币电池的比容量高于第一次充放电循环。比容量是评价电化学储能系统的一个关键参数,因为它决定了电极材料每单位质量或单位面积可存储的电荷量。低比容量会限制系统的整体性能和能量密度。此外,容量保持也是一个需要考虑的重要因素,因为它反映了电极材料在多次充电/放电循环中的稳定性。低容量保留可能导致电极的快速降解,这可能导致性能下降随着时间的推移。在0.05 ~ 1 A/g不同电流密度下,对氧化石墨烯电极的充放电速率性能进行了研究,如图11(d)所示。CD的显著增加可能会促进LiPF6 OE在GO阳极锂离子电池中的腐蚀。因此,在高电流密度(1 a /g)下,氧化石墨烯阳极循环功率的降低可能是由于电解液腐蚀产生的Li+被利用以及金属锂在阳极表面的作用。图11(e)给出了氧化石墨烯阳极在电流密度为0.05A/g次、充放电循环次数为200次时能量(mWh)充放电研究的GCD稳定性。图11(f)显示了在不同电流密度下10次放电/充电的氧化石墨烯电极能量(mWh)研究的GCD速率能力。
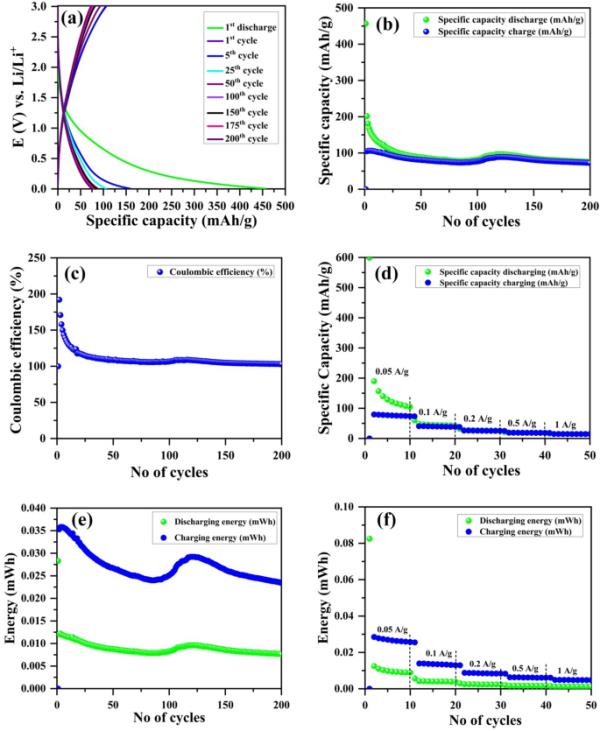
(a)典型的充放电的电极在1日5日,25日,五十,100,150,175,和200周期为0.05 a / g, (b)的特定能力去电极电流密度为0.05 a / g 200周期,(c)充电/放电效率和循环的电极,(d)率的性能去电极在不同电流密度/ 0.05 g / g 0.1, 0.2 a / g / g、0.5和1 / g不同电流密度的周期是10,(e) 0.05 A/g电流密度下氧化石墨烯电极循环数与能量放电/充电(mWh)曲线,(f)不同电流密度下氧化石墨烯电极循环数与能量放电/充电(mWh)曲线
对于LIC半硬币电池,图12(a)显示了0.05 a /g下200次循环稳定性的恒流充放电(GCD)曲线。结果表明,经过200次循环后,电池的比电容从369.1 F/g下降到231.8 F/g。图12(b) 0.05 A/g,图12(c) 0.1 A/g,图12(d) 0.2 A/g,图12(e) 0.5 A/g,图12(f) 1 A/g,在1m LiPF6电解质中进行了不同ACD下的GCDs。在没有循环的情况下,研究了不同电流密度下的GCDs(图12(g))。图12(h)氧化石墨烯阳极电极在0.05 A/g到1 A/g不同电流密度下功率密度(W/kg)和能量密度(Wh/kg)的Ragone图。
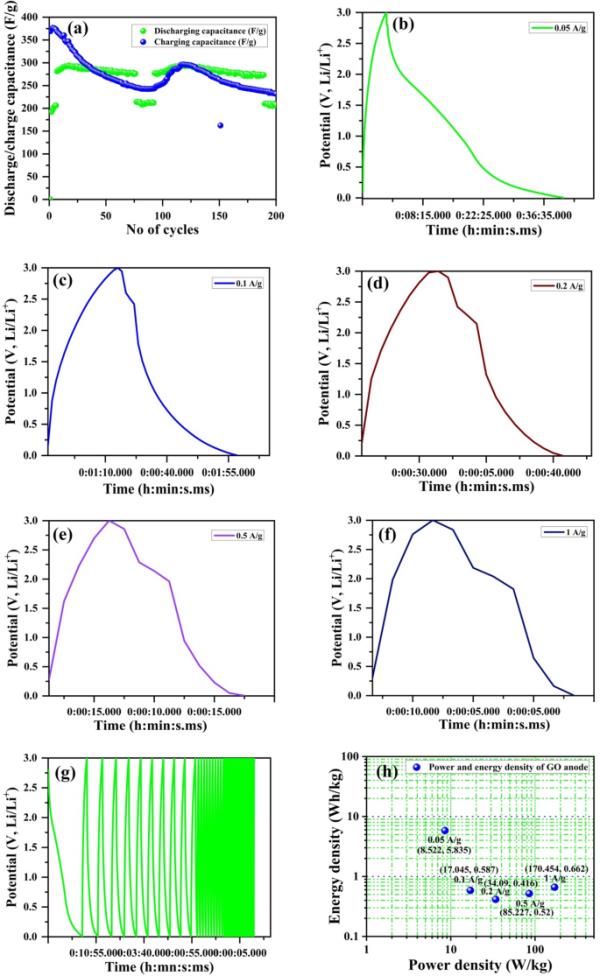
(a)比电容(F/g)(放电/充电)与0.05 a /g下循环次数的关系,200次循环的稳定性,不同电流密度下的恒流充放电曲线,(b) 0.05 a /g, (c) 0.1 a /g, (d) 0.2 a /g, (e) 0.5 a /g, (F) 1 M LiPF6有机电解质溶液随时间与电位0.0 ~ 3.0 (V, Li/Li+)下的恒流充放电曲线,(g)不同电流密度下的0.05 a /g, 0.1 a /g, 0.2 a /g, 0.5 a /g,1 A/g, 1 M LiPF6有机电解质溶液,在时间vs电势0.0 ~ 3.0 (V, Li/Li+), (h) Ragone图与不同电流密度下的功率密度(W/kg)和能量密度(Wh/kg)
GCD曲线是非线性的,这归因于半电池氧化石墨烯阳极作为LIC的赝电容机制。石墨(G)和氧化石墨烯(GO)在整个充放电过程中显示出大约0.1 V的稳定电压平台(相对于Li/Li+),并且当与活性炭(AC)配对时可以提供高工作电位,这使得它作为半硬币电池使用的锂离子电池阳极具有吸引力。在第一次放电时,电势迅速下降,并在0.19 V处趋于平稳,这可能对应于氧化石墨烯阳极中固体-电解质间相(SEI)层的形成。SEI层作为阳极表面的保护层,有助于防止锂离子与电解质发生反应,从而实现高效的充放电循环。此外,该GCD信息被用于计算半硬币电池作为锂离子电容器的比容量和电容。比电容随着CD的增大而减小,因为在电流增大时,电化学反应只涉及氧化石墨烯阳极的外壳,其比电容值降低[82]。这种优异的氧化石墨烯性能可能是由于氧化石墨烯的部分减少,从而提高了电导率,同时在氧化和还原过程中保持了大量的C=O基团。此外,氧化石墨烯阳极由于其假电容性,部分显示出电荷存储容量的增加,影响峰值电压活性基团(C=O/C - O)的氧化和还原,并伴有显著的Li+摄取。GCD速率能力是集成电路和锂离子电池氧化石墨烯阳极材料的宝贵属性,特别是在设想高功率密度应用(如汽车应用)时。迄今为止,通过减少碳涂层和颗粒尺寸来提高速率的努力提高了电子和离子导电性。然而,也出现了一些不同的观点[83],认为额外容量归因于OH,但COOH、内酯和C=O导致了不可逆的充放电过程[84]。因此,在锂离子电池和锂离子电池的GCD电化学研究中,提示了氧化石墨烯的其他活性基团的功能。如上所述,GO的制备方法简单、可扩展且具有成本效益。
下载原文档:https://link.springer.com/content/pdf/10.1007/s12648-023-02647-6.pdf