摘要
人类圈中化学物质的数量正在增加,其中一些最终进入了人类体内。进行了文献检索,以评估在一般人群的血液中分析了哪些人为有机污染物(OCs)。这些被审查的文章被用来创建一个研究数据库[人类血液数据库(HBDB)],其中包含559篇OCs]报告了全世界的血液分析。所有分析瑞典人群血液的研究都被编入第二个数据库[瑞典暴露数据库(SEDB),包含166种OCs],列出了OCs的血液浓度。SEDB的数据显示,随着时间的推移,血液中受管制的化学物质水平下降,表明监管已经产生了影响。采用危害指数(HI)方法对已建立的人类生物监测指导值(HBM-GVs)和SEDB血液水平的OCs进行定性混合风险评估。9例hbm - gv被发现,相应OCs/ OCs组的HI显示不能排除一般人群中不良反应的风险,考虑到SEDB中分析的OCs中只有一小部分被纳入,这是一个令人担忧的原因。本研究介绍了人体血液中所鉴定的OCs及其浓度变化趋势。该研究强调,缺乏混合风险评估所需的hbm - gv,以评估化学物质暴露给一般人群的综合风险。
介绍
几十年来,随着人类圈变得越来越复杂,化学品的生产和使用在全球范围内有所增加(Eurostat 2021)。文明疾病(如2型糖尿病、肥胖症等)和自身免疫性疾病在过去几十年中有所增加(Huhn et al. 2021)。遗传因素只能占此类疾病风险的30%,而其余风险可能归因于环境差异(Rappaport和Smith, 2010;Vojdani et al. 2014)。这种环境差异被描述为暴露量,即同时和连续环境暴露的总和(Rappaport和Smith, 2010)。造成接触量的一个因素是化学品接触,欧洲委员会最近将其称为对人类健康的威胁(欧洲委员会2020年)。
有一系列不同类型的样品可用于评估人类接触化学物质。通常,通过分析人体摄入基质(如食物、空气等)来评估对化学品的暴露,反映外部暴露。人体生物监测使用人体体液和组织来测量目标化学物质的暴露。由于血液与整个生物体的器官和组织保持平衡,血液是人为有机污染物(OCs)的理想基质(Esteban and Castano 2009)。因此,血液反映了体内的有机碳水平,包括化学物质的摄取和代谢。此外,血液是反映普通人群长期暴露的基质,而尿液主要反映短期暴露。母乳是另一个相关的监测矩阵,尽管它只反映妇女和婴儿接触化学物质的情况。
生物监测计划用于捕捉化学品暴露的时间变化,调查何时需要进行管制,并监测管制是否有预期的结果。健康相关环境监测(HÄMI)是瑞典政府资助的生物监测项目,由瑞典环境保护局(SEPA)管理。1993年,启动了HÄMI,以长期监测人体中不同基质的无机和有机污染物(瑞典环境保护局2021年)。迄今为止,HÄMI涵盖了人类基质中分析的380多种人为OCs(瑞典环境保护局2021年)。美国疾病控制与预防中心(US- cdc)实验室科学部负责管理美国国家生物监测计划(NHANES),该计划监测400多种环境化学物质,包括人体血液和尿液中的有机化合物和金属(美国疾病控制与预防中心,2020年)。2017年,欧盟启动了欧盟人类生物监测(HBM4EU)项目,该项目由24个成员国、挪威、冰岛、以色列和瑞士以及欧盟委员会和欧洲环境署合作开展。HBM4EU已将19种具有风险相关问题的有机和无机化学品或化学品组列为优先事项,目的是协调欧洲的人类生物监测工作,增进对化学品接触时间变化的了解,并为制定保护人类健康的化学品政策提供证据(HBM4EU 2020)。欧盟委员会的化学品监测信息平台(IPCHEM)提供了欧盟内不同生物监测计划的更多信息(欧盟委员会2021年)。此外,通过纳入同行评审的文献数据来评估化学品暴露非常重要,因为生物监测计划仅涵盖有限数量的化学品(Bopp et al. 2019)。具有持久性、生物蓄积性、潜在的远距离环境迁移以及对人类或环境产生不利影响的化学品被归类为持久性有机污染物(POPs)(《2020年斯德哥尔摩公约》秘书处)。2004年生效的《斯德哥尔摩公约》是一项合作战略,旨在将这类化学品从市场上清除(2020年《斯德哥尔摩公约》秘书处)。自那时以来,作为该协定的一部分,一系列生物监测规划监测了人体和环境中的持久性有机污染物。HÄMI报告用于在国家一级跟进《斯德哥尔摩公约》的时间趋势。
单一化学品的传统风险评估通常基于外部暴露剂量,源自体内实验数据。然而,当使用血液浓度作为暴露数据时,风险评估需要内部暴露剂量水平。在动物实验中,很少测量外照射后的内剂量。人体生物监测指导值(HBM-GVs)或生物监测当量(BE)值表示可接受的内照射剂量水平。德国人体生物监测委员会的HBM-GV I和BE值是人体基质中的浓度限值,低于该限值没有不良影响的风险(Hays et al. 2007, HBM-Communication 2020)。德国人类生物监测委员会已经定义了一个额外的更高的HBM-GV (HBM-GV II)。当血液水平超过HBM-GV II时,需要采取措施减少暴露(HBM-Communication 2020)。在这里,HBM-GV I和BE值相等,记为HBM-GV。由于缺乏既定值和生产新的hbm - gv所需的时间,hbm - gv的使用受到限制(Apel et al. 2020)。此外,这些值不应该被认为是静态的,当有新的毒性数据时,这些值需要更新。根据现有数据,hbm - gv可以通过流行病学数据、原位模型或使用评估因子(AF)获得体内数据(Apel et al. 2020)。HBM4EU旨在增加hbm - gv的数量,最近生产了镉、双酚A、n -甲基-2-吡咯烷酮(NMP)、n -乙基-2-吡咯烷酮(NEP)和一些邻苯二甲酸盐的尿液hbm - gv (David等人,2021;Lamkarkach et al. 2021;Lange et al. 2021;Ougier et al. 2021)。
当已知一组化学物质的暴露和固有毒性时,有不同的方法来计算化学物质的综合风险。混合风险评估(MRAs)是对综合暴露的影响进行评估。一种MRA方法是使用危害指数(HI)方法,该方法由美国环保署于1986年提出,并于2000年进行了补充(美国环境保护局1986年)。HI方法假定浓度增加,这意味着混合物的每种成分通过相同的作用方式增加毒性。当使用hbm - gv时,在计算HI时只能获得定性的MRA,因为它们所基于的关键效应对于不同的oc是不同的。所有hbm - gv都有额外的安全边际。当使用hbm - gv时,不同的临界效应可以在MRA中组合,因为安全边际产生保守的HI (Bopp等人,2019)。然而,导致相同不良结果的OCs可能协同作用,与它们共同作用时相比,可能造成更大的影响(Kortenkamp和Faust 2018)。
为了能够评估化学品混合物的综合风险,需要以一致的方式进行毒性评估和报告,例如关于物种、终点和报告的毒理学剂量描述符。为更多的化学物质找到这些信息可能是一个挑战(Engelhardt et al. 2021)。
本研究的第一个目的是对瑞典普通人群血液中人为oc进行暴露评估。此外,还收集了世界各地人类血液中所分析的OCs的身份。在这项研究中发现的大部分化学物质是持久性有机污染物,因为它们通常在血液中被分析。在可能的情况下,建立血液中OCs的时间趋势,以遵循法规的实施。本研究的第二个目的是通过应用现有的用于血液的hbm - gv,评估瑞典普通人群中报告的血液中OCs混合物暴露的综合风险。
方法
人类血液中的OCs
这些数据是通过对科学文献的回顾和从选定的、可访问的生物监测项目中纳入OCs收集的。检索时间为2019年9月至2020年12月,检索关键词为“血液”、“血清”、“人”、“污染物”、“化学物质”、“物质”、“污染物”和“分子”。该收藏仅限于2000年至2020年之间发表的文章。除英语或瑞典语以外的其他语言的文章,以及专注于药物或无机物的研究都被排除在选择过程之外。只使用了分析一般人群血液的文章,即排除了分析慢性病患者的研究以及对居住在受污染地点附近的人的研究。文献检索的详细描述可以在支持信息中找到(在线资源2,表S1-2)。收集的oc被编入人血数据库(HBDB)。HBDB中分析瑞典血液的研究中的血液浓度被纳入瑞典暴露数据库(SEDB)。为此,“瑞典”或“瑞典”被添加到搜索条件中。在人类血液中分析的OCs,在卤代持久性有机污染物国际研讨会上报告,并在二恶英数据库(2020年卤代持久性有机污染物国际研讨会)中提供,该数据库包含2000年至2020年发表的摘要和扩展的同行评审摘要,被纳入HBDB。在血液中分析并在美国疾病控制和预防中心(US- cdc)的《人类接触环境化学品国家报告》(NHANES)中报告的OCs被添加到HBDB(美国疾病控制和预防中心2019年)中。HBDB包含245篇文献(10,829个条目)和两个生物监测程序(图1)。
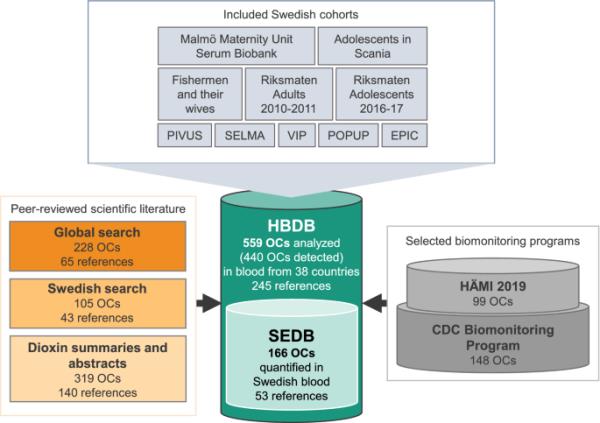
人类血液数据库(HBDB)和瑞典暴露数据库(SEDB)的数据收集过程。数据库中的参考文献定义为文章、摘要/扩展摘要或生物监测程序
在SEPA HÄMI数据库中报告的所有分析都被添加到SEDB(瑞典环境保护局2021)中。SEDB包括53篇参考文献(6476个条目)和一个生物监测项目(图1)。在SEDB中,同行评审文献所涵盖的队列包括欧洲癌症和营养前瞻性调查(EPIC) (Slimani等人,2007)、乌普萨拉老年人血管系统前瞻性调查(PIVUS) (Lind等人,2005)、乌普萨拉初级居民持久性有机污染物(POPUP) (Glynn等人,2007)、Riksmaten成人2010-2011(瑞典环境保护局2021)、2016-2017年Riksmaten青少年(瑞典食品署等人,2020),Västerbotten干预计划(VIP)(对照)(Norberg等人,2010),渔民及其妻子(Rylander和Hagmar 1995;Svensson等人,1995),Malmö产科单位血清生物库(MMUSB) (Ode等人,2014),瑞典环境纵向,母亲和儿童,哮喘和过敏研究(SELMA) (Bornehag等人,2012),Scania青少年(norsamn等人,2020)以及仅用于一项研究的小群体(图1)。从所有文章中手动提取血液样本的化学特性,原产国和采样年份,并输入HBDB。此外,对于瑞典血液中分析的OCs, SEDB包括浓度范围(最小-最大)、平均浓度、队列、性别、LOD/LOQ值和分析的个体数量。这些条目是根据从女性、男性、“两者”(当个体性别未确定或浓度报告为汇总平均值时)以及儿童和青少年(0-20岁)中确定的人体血液中的浓度进行划分的。
在HBDB中,包括所有在血液中分析过的OCs,并在HBDB中指出报告的低于检测水平(< LOD)的OCs(在线资源1;HBDB概述)。在SEDB中,只有报告高于定量水平(> LOQ)的OCs被包括在内(在线资源1,SEDB),即在瑞典血液中分析的任何时间点分析但未检测到高于定量水平(< LOQ)的OCs不被包括在SEDB中。如果一篇以上的文章报道了来自同一队列和性别的某一特定OC水平,且浓度非常相似,则假设结果来自同一分析。化学标识符(如CAS、SMILES、InChIKey)取自CompTox Chemical Dashboard、ChemSpider、PubChem和SciFinder。根据《斯德哥尔摩公约》,每种化学品都有一个唯一的标识号(化学品标识号),并根据化学品类别、结构标识符(芳香、卤化、酚类和/或仅为OCs)、卤素类型(溴化、氯化、氟化或非卤化)和持久性有机污染物/持久性有机污染物代谢物状态进行分类。一起报告的有机化合物(共洗脱液和同源物的总和,如∑pcb)不包括在数据库中,除了7种全氟化合物,它们被报告为线性、支链异构体或未指定时未定义。
为了能够比较不同的研究,将浓度转换为湿重和脂质调整重量。当未报告人血清脂质浓度时,基于0.65%的脂质百分比和1.024 g/mL的人血清密度,使用0.006656 g/mL的默认值(Sniegoski和Moody 1979;Weiss et al. 2006)。血浆脂质百分比为0.42%,其密度估计与血清相同(Hovander et al. 2000;Sniegoski and Moody 1979)。当基质为全血或除“血”外未指定时,用血清脂质浓度。为了进行比较,尽管一些亲脂化学物质通常以脂质调整后的重量表示(可在SEDB中获得,在线资源1,SEDB),但图中的所有结果都以湿重(pg/mL)表示。对于分析超过5年的OCs的时间趋势,对浓度的对数值应用线性回归模型,以检查是否存在显著的时间趋势(p值< 0.05)。当时间与浓度关系显著时,在反对数图上加一条与对数值相关的线性回归线。进行敏感性测试以检查LOQ以下的值对每个图的时间趋势的影响。对于每个数据集,低于LOQ的值被设置为0、LOQ/2或LOQ,并记录趋势的斜率和趋势的p值(表S3)。在绘制图中的趋势线时,不包括低于LOQ水平的浓度(对应LOQ = 0)。随着时间的推移,LOQ水平随着分析方法的改进而降低。一些定量限值高于或与其他研究报告的浓度范围相同。LOQ值已包含在图表中,以说明实验室的性能和分析的数量。敏感性测试表明,在不同的情况下,坡度没有剧烈变化(表S3)。
风险评估
HI是一种基于组分的方法,用于评估化学混合物的综合风险。通过第i种化合物的暴露水平(Exp)除以第i种化合物的可接受水平(AL),计算出每种OC的危害商(HQ) (Eq. 1)。将hq求和为混合液的HI(式1)。如果HI超过1,则不能排除对一般人群产生不良影响的混合风险,因此需要进一步改进(美国环境保护署1986年)。在这里,整个人群每年的平均血液浓度被用作暴露水平(在线资源1,MRA)。通过使用血液浓度作为暴露量,我们被限制使用作为内部浓度报告的AL,而不是通常从体内研究中报告的给药剂量。因此,采用血hbm - gv。hbm - gv取自同行评议文献和德国人类生物监测委员会(Aylward et al. 2010;Aylward et al. 2008;HBM-Communication 2020;Kirman et al. 2011;Krishnan et al. 2011)。在补充信息(在线资源2,表S4)中可以找到所有hbm - gv、其各自的关键端点和有关衍生过程的其他信息的汇总表。除二恶英样化合物(PCDD/Fs和dl-PCBs)外,所有HBM-GVs均被转换为湿重(pg/mL),使用与先前描述的血液浓度相同的脂质百分比和密度。PCDD/Fs和dl- pcb的HBM-GV为脂质调节TEQ值。因此,使用来自(Van den Berg et al. 2006)的TEF值将暴露浓度转换为相同的单位。TEQ总和是根据7种二恶英、10种呋喃和12种多氯联苯的血脂调节血液浓度计算的。
(1)目录
摘要介绍
方法
结果
讨论
结论
数据可用性
代码的可用性
参考文献
作者信息
道德声明
补充信息
搜索
导航
#####
结果
人类血液中的OCs
这两个数据库在在线存储库(在线资源1、HBDB和SEDB)中可用。HBDB包括在人类血液中分析的559种OCs,其中报告检测到440种OCs (> LOD/LOQ)。对于HBDB中的OCs,大多数(83%)是卤化的,49种OCs(11%)同时是卤化,酚和芳香的(图2)。在HBDB中,54%的OCs是持久性有机污染物,9.1%是持久性有机污染物的代谢物(在线资源2,表S5)。HBDB包含来自38个国家的血液中分析的OCs,主要来自西欧、北美和亚洲(在线资源2,表S6)。
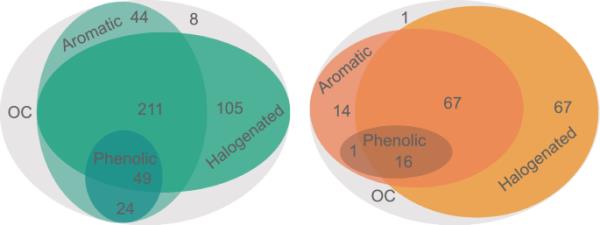
描述人类血液数据库(HBDB,左)和瑞典暴露数据库(SEDB,右)两个数据库中检测到的OCs特征的维恩图
SEDB包括166种有机污染物,其中91%是卤化的(图2)。在SEDB中,57%的有机污染物是持久性有机污染物,10%是持久性有机污染物的代谢物(在线资源2,表S5)。在瑞典,血液中分析的OCs主要是受管制的OCs。瑞典分析的OCs包括阻燃剂、多氯二苯并对二恶英和呋喃(PCDD/F)、氯化农药及其代谢物、多氯联苯(PCBs)及其代谢物、多氟和全氟烷基物质(PFASs)和邻苯二甲酸盐(图3)。除了SEDB中的化学基团外,HBDB还包括烷基酚、氯化石蜡、阻燃代谢物、多环芳烃(PAHs)、对羟基苯甲酸酯、个人护理产品成分、溶剂和紫外线过滤器(图3)。在瑞典,对尿液中的烷基酚、双酚、多环芳烃、对羟基苯甲酸酯、个人护理产品成分和紫外线过滤器进行了分析(瑞典环境保护局2021)。在线资源2表S7中列出了HBDB和SEDB中所有化学基团的列表以及血液采样的时间框架。
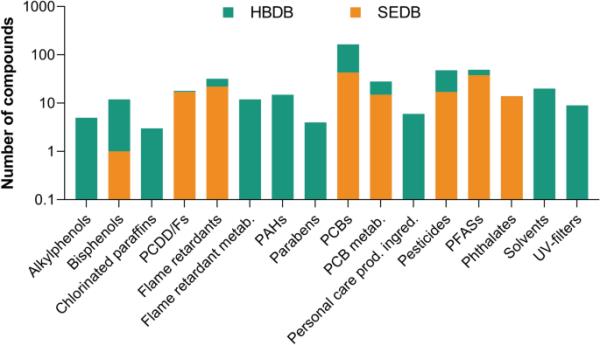
人类血液数据库(HBDB,绿色)和瑞典暴露数据库(SEDB,橙色)中各组OCs(包括异构体)的化学群和数量
对于一些选定的OCs,列出了研究的数量和分析的个人数量,以说明对性别和年龄组的关注(在线资源2,表S8)。似乎最常分析的是妇女和儿童的血液,其次是报告所有成年人血液水平的研究。男性的分析报告数量最少。
瑞典血液水平
血液中通常监测到的化学类群是多氯联苯、农药、全氟辛烷和阻燃剂(图4)。人体血液中报告的平均含量最高的OCs是全氟辛烷磺酸(PFOS),最高水平为全氟辛烷磺酸(PFHxS)和全氟辛酸(PFOA)(图4a, b)。在全氟辛烷磺酸中,全氟辛烷磺酸和全氟辛烷磺酸受《斯德哥尔摩公约》(附件A和b)监管。2019年,PFHxS被提议列入《斯德哥尔摩公约》(2019年《斯德哥尔摩公约》秘书处)。妇女和儿童的全氟丁烷磺酸(PFBS)呈增加趋势(在线资源2,图S1),但大多数全氟丁烷磺酸呈减少趋势(在线资源2,图S1-11)。自2004年以来,多氯联苯已受到《斯德哥尔摩公约》(附件A)的限制,根据同系物的不同,多氯联苯在血液中的含量约为100 pg/mL(图4c, d)。与其他化学类相比,溴化阻燃剂在血液中的含量较低,在血液中的平均含量约为10 pg/mL(图4e;在线资源2,图S2)。人类血液中分析的大多数农药是持久性有机污染物(图4f),受《斯德哥尔摩公约》(附件A和B)管制。瑞典人血液中五氯酚(PCP)的平均含量可达7000 pg/mL(图4g),反映出森林工业大量使用这种防腐剂(Palm et al. 2002)。所分析的有机磷阻燃剂二正丁基磷酸不受调节,其血液浓度高于溴化阻燃剂,平均血液浓度约为1000 pg/mL (SEDB在线资源1)。邻苯二甲酸酯和双酚a仅在1999年至2009年期间在血液中进行了分析(表S7),而且报告的分析报告太少,无法讨论时间趋势。一般来说,极性物质比非极性OCs(通常是持久性有机污染物)更容易结合并通过尿液排出。因此,极性OCs及其代谢物更常在尿液中进行分析,并且与SEDB(瑞典环境保护局2019年)中其他OCs的报告程度不同。
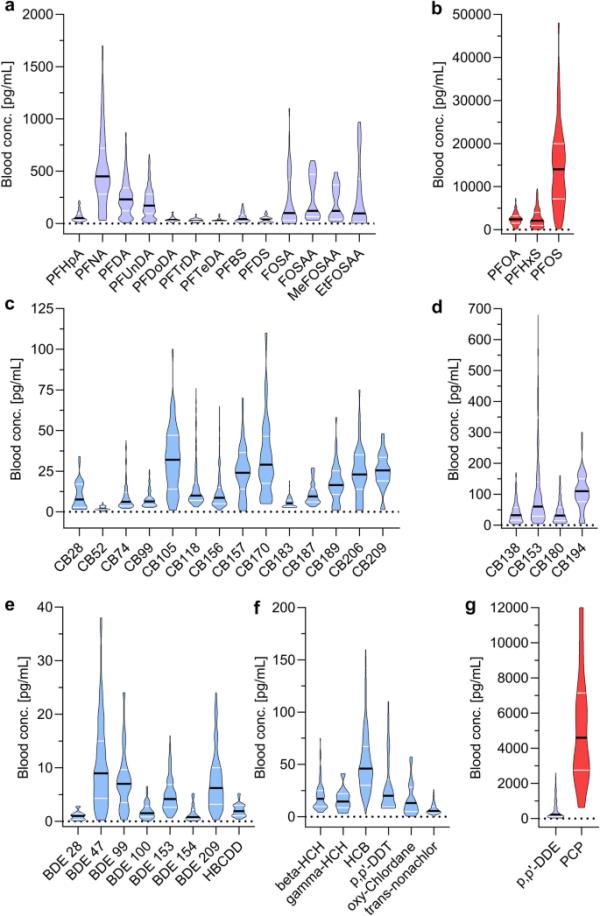
瑞典普通民众血液中的化学成分。小提琴图的宽度对应于某一浓度的频率,小提琴越宽,该浓度在数据集中出现的频率越高。图中的颜色对应于每个OC浓度的大小,从高(红色)到低(蓝色)。每个OC的浓度范围在图中以一条黑线表示为平均浓度,每侧两条白线表示第25和第75百分位数。该范围对应于识别出异常值后的最小最大值(Q = 1的路由测试)a-b PFASs c-d pcb e PBDEs f-g农药
风险评估
在SEDB (online Resource 1, MRA)报告的OCs或OCs组中发现了9个hbm - gv。多氯联苯的HBM- gv已被德国HBM委员会设定为3500 pg/mL,为CB138, CB153和CB180的浓度之和(HBM- communication 2020;Rauchfuss et al. 2013)。瑞典人群血液中三种多氯联苯的总浓度低于HBM-GV。自2004年以来,该群体的报告一直低于该值(图5a),当时它首次受到斯德哥尔摩公约的管制(2020年斯德哥尔摩公约秘书处;瑞典化学品管理局(2021)。瑞典一般人群血液中多氯联苯的浓度正在下降(图5 - d)。pcb的最新HQ为0.032(图9a)。
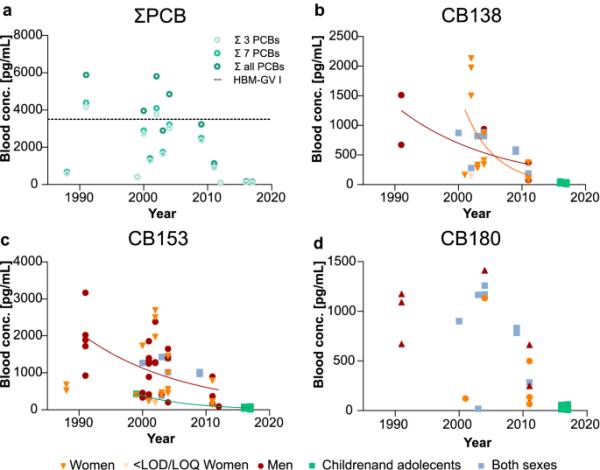
一些pcb的时间趋势。p值< 0.05时添加趋势线。多氯联苯(CB138、CB153、CB180)血药浓度Σ3;Σ7 pcb (CB28, CB52, CB101。CB118, CB153, CB138, CB180)和Σall pcb。水平线对应于Σ3 pcb的设定HBM- gv (HBM Commission 2020;Rauchfuss et al. 2013)。b CB138 c CB153 d CB180的时间趋势
很少有研究报告了PCDD/Fs和二恶英样多氯联苯(dl-PCBs)的血液水平(图6;在线资源2,表S8)。自2004年起,PCDD/Fs受《斯德哥尔摩公约》(附件C)监管(《2020年斯德哥尔摩公约》秘书处;瑞典化学品管理局(2021)。最新的四项分析(2003年之后)只报告了dl- pcb(图6),因此计算的TEQ水平不包括PCDD/ f。dl-PCB的TEQ水平低于HBM-GV的15 ppt (Aylward et al. 2008)。对PCDD/Fs的分析没有达到与对dl-PCBs相同的程度,由于缺乏数据,很难断定总水平是否与不利影响的风险有关。由于同系物的数量在整个时间段内不同,因此无法对趋势进行解释(在线资源1,MRA)。在分析所有PCDD/Fs的两个例子中(1987年和2002年),该组的总血液水平超过HBM-GV。dl- pcb的最新总部为0.0000037(图9a)。
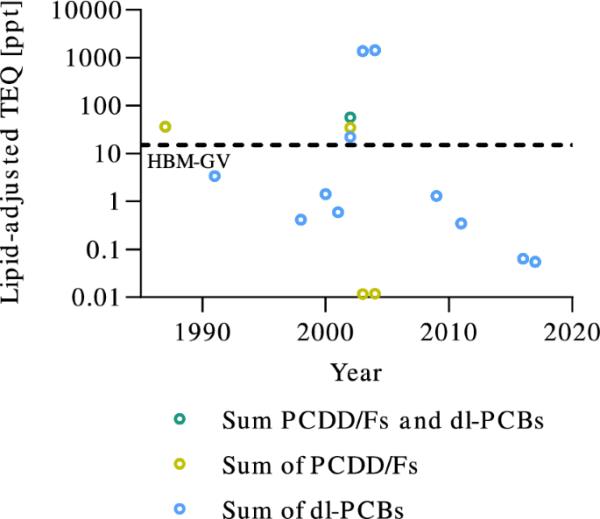
7种二恶英(绿色)、10种呋喃(PCDD/Fs,黄色)和12种dl-PCBs(蓝色)的总TEQ水平的时间趋势。15 ppt处的虚线是PCDD/Fs和dl- pcb的设置HBM-GV (Aylward等人,2008年)。由于分析的同系物数量在整个时期有所不同,因此无法对趋势作出解释
自2004年起,六氯苯(HCB)受《斯德哥尔摩公约》(附件A)管制(《2020年斯德哥尔摩公约》秘书处;瑞典化学品管理局(2021)。从1990年到2012年,六氯环己烷在男性中的浓度呈下降趋势(图7a)。在分析样本的最后一年(2017年),平均暴露值低于设定的HBM-GV 170 pg/mL (Aylward等人,2010年)。自2004年以来,妇女血液中HCB浓度有所下降。HCB的最新总指挥部为0.31,是当年(2017年)第三高的总指挥部值(图9a)。农药滴滴涕于2004年加入《斯德哥尔摩公约》(附件B)(2020年《斯德哥尔摩公约》秘书处;瑞典化学品管理局(2021)。p,p′-DDT的主要代谢物是p,p′-DDE,分析频率高于母体化合物。与p,p ' -DDE相比,p,p ' -DDT的水平较低,表明了历史上的使用。报告的p,p′-DDT和p,p′-DDE的平均水平均呈下降趋势。男性和儿童血液中p,p′-DDE水平的降低具有统计学意义。2013年,在最近报告的女性血液样本中,女性的浓度是最低的(图7b)。p,p′-DDT没有明显的变化趋势。所有报告的水平都低于设定的HBM-GV,即p,p + -DDT和p,p + -DDE的总和为33,000 pg/mL (Kirman et al. 2011)。p,p′-DDT和p,p′-DDE的最新HQ为0.0077(图9a)。
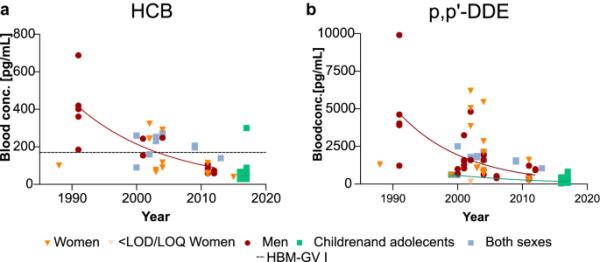
a瑞典普通人群血液中六氯苯(HCB)的浓度。黑色水平虚线对应于血液中HBM-GV的集合(Aylward et al. 2010)。b瑞典普通人群p,p′-DDE血药浓度。p,p′-DDT和p,p′-DDE的HBM-GV为33,000 pg/mL。p值< 0.05时添加趋势线
全氟辛烷磺酸是SEDB中所有OCs血液含量最高的一组(图4a, b)。自2009年以来,全氟辛烷磺酸受到《斯德哥尔摩公约》(附件b)的监管,自2019年以来,全氟辛烷磺酸受到监管(附件A)(瑞典化学品管理局2021年)。在研究期间,男性和女性的全氟辛烷磺酸和全氟辛烷磺酸的血液浓度一直在下降。最新的全氟辛烷磺酸分析报告的水平接近HBM-GV,为5000 pg/mL (Hölzer et al. 2021), HQ为0.58(图8a, 9a)。PFOA的HBM-GV为2000 pg/mL,最新分析显示其水平低于该值(图8a) (Hölzer et al. 2021)。PFOA的最新HQ为0.58(图9a)。2010年以前,一般人群和育龄妇女的全氟辛烷砜血液浓度分别高于HBM-GV II的较高设定20,000 pg/mL和10,000 pg/mL(图8a) (HBM-Communication 2020)。当浓度超过HBM-GV II时,需要采取措施避免对一般人群产生不良影响(HBM-Communication 2020)。
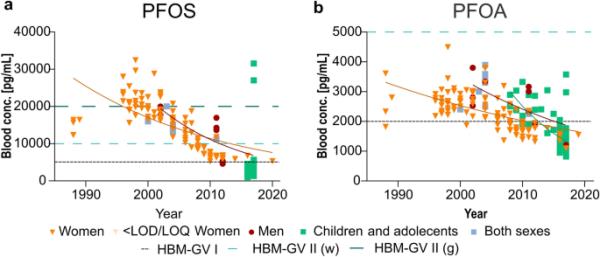
瑞典普通人群血液中a全氟辛烷磺酸和b全氟辛烷磺酸水平的时间趋势。黑色水平虚线对应德国人类生物监测委员会的HBM- gv I,绿色虚线对应HBM- gv II,其中(w)为育龄妇女的HBM- gv II(浅绿色),(g)为一般人群的HBM- gv II(深绿色)(HBM委员会2020;Hölzer et al. 2021)。p值< 0.05时添加趋势线
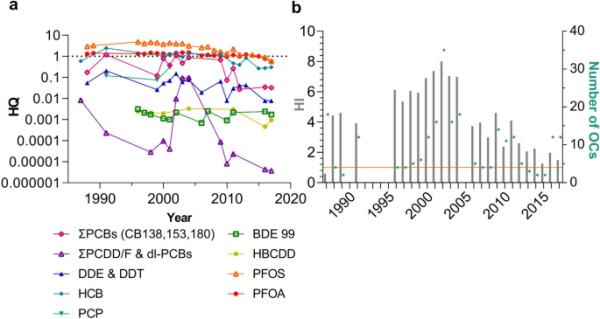
a不同OC的危险系数(HQ),由每种OC的平均血药浓度除以HBM-GV b ΣHQ危险指数(HI)计算。当HI高于1时,不能排除一般人群的不良反应风险(橙色水平线)。绿点对应于每年纳入HI的OCs数量
对每年9种OCs/ OCs组的HQ计算表明,一些OCs至少在一年内超过了1个单独的风险阈值(ΣPCBs, HCB, PFOS和PFOA)(图9a)。具有hbm - gv的OCs都受《斯德哥尔摩公约》的监管,正如预期的那样,在报告的时间段内,大多数总部都在减少(瑞典化学品管理局2021年)。当考虑综合风险时,最高的HI发生在2004年,风险是可接受风险的8倍(图9b)。在研究期间,全氟辛烷磺酸和全氟辛烷磺酸是导致风险的因素。PCDD/Fs和dl- pcb的峰值出现在2002年(图9a, b)。自1988年以来,HI每年都在1以上,全氟辛烷磺酸和全氟辛酸是驱动因素。假设对单一化学品进行风险评估,2015年后,没有任何一种有机化合物单独构成不利影响的风险。然而,HI为1.5,2017年仍高于1,突出了评估化学品暴露综合风险的重要性(图9a, b)。
讨论
本研究的总体目标是概述当前瑞典普通人群血液中OCs的化学暴露情况,并通过人工查阅科学文献和人类生物监测数据列出世界范围内血液中分析的OCs。在另一项研究中,通过使用文本挖掘和数据库融合方法汇编人类血液中发现的化学物质来估计暴露量(Barupal和Fiehn 2019)。这项研究产生了一个包含人体血液中发现的4.1万多种化学物质的数据库,包括有机和无机、内源性代谢物、外源性药物等。需要人工管理来提取本研究的目标有机污染物,即从该研究中提取人为有机污染物。据我们所知,HBDB是迄今为止最全面的血液OCs列表。最有可能的是,更多的OCs可以添加到HBDB中,因为我们并没有声称对全球人类血液中分析的OCs进行了详尽的审查。
一般来说,HBDB和SEDB中报告的大多数有机污染物都是受《斯德哥尔摩公约》管制的持久性有机污染物。由于基质的选择和《斯德哥尔摩公约》要求监测附件A、B和C所列化学品(第11条),这符合预期结果(Esteban and Castano 2009;2020年《斯德哥尔摩公约》秘书处)。
由于PCDD/F分析的目标基质已改为母乳(2004年对大多数同系物),因此能够看到血液中PCDD/F水平的时间趋势的分析太少了。据报道,母乳和鱼类(这些污染物的主要来源)中PCDD/F和dl-PCBs的浓度随时间呈下降趋势(Gyllenhammar等人,2021;Miller et al. 2012)。此外,血液和乳汁中OCs的下降趋势表明,监管工作是必要和有效的。根据SEDB的数据,在过去的十年中,血液中没有分析过一些有机化合物,特别是酚类有机化合物,如oh -多氯联苯(多氯联苯的代谢物)、双酚类和邻苯二甲酸盐。相反,非卤化极性OCs通常在尿液中进行分析,如烷基酚、双酚、对羟基苯甲酸酯、个人护理产品成分和紫外线过滤器(Esteban和Castano 2009;瑞典环境保护署(2021)。氯化石蜡是HBDB中目前唯一未在HÄMI中涵盖的化学基团。短链氯化碳于2017年被列入《斯德哥尔摩公约》附件A,中链氯化碳目前正被提议列入附件A。瑞典人口血液中CPs水平的首次筛查正在由HÄMI计划(个人信息来自合著者K. Norström)。
通过查看SEDB中的数据,血液中浓度最高的OCs是全氟辛烷磺酸(PFOS > PFHxS > PFOA)。在全球范围内分析了几种PFASs (n = 50)(在线资源1,HBDB),这可能反映了在世界各地发生明显暴露后公众意识的提高,引起了对人类健康的关注(Sunderland et al. 2019)。全氟辛烷磺酸和全氟辛烷磺酸的血液水平显示出相似的下降趋势(图8),尽管全氟辛烷磺酸比全氟辛烷磺酸晚10年加入POP列表。其他全氟辛烷磺酸已经取代了以前使用的全氟辛烷磺酸和全氟辛酸,其中一些显示出增加的水平(PFBS和PFHxS,见在线资源2,S1和S6),或在妇女中的水平增加,但在儿童中的水平下降(PFNA PFDA, PFUnDA, PFTrDA,见在线资源2,S8-11)。
欧洲HBM仪表板提供来自HBM4EU项目中现有HBM数据收集的汇总统计信息。与SEDB的比较显示,挪威、德国、比利时、西班牙、丹麦和捷克在欧洲HBM仪表板中报告的PFASs水平相似,而斯洛伐克和奥地利报告的PFASs水平较低(弗拉芒技术研究所等,2021年)。欧洲HBM仪表板也报告了多溴二苯醚,比利时和丹麦等国的多溴二苯醚水平与SEDB中的水平相似,而斯洛伐克的水平更高(弗拉芒技术研究所等人,2021年)。
开发和验证新兴化学基团的新分析方法需要时间和资金,因此在国际监测计划中开发的统一方法非常重要(HBM4EU 2020)。HBM4EU最近发表了一篇综述,讨论了用于分析选定化学品范围的不同分析方法(Vorkamp et al. 2021)。报告分析方法LOD和LOQ值是一种有价值的质量控制,可以更好地了解实验室的性能和分析质量。随着分析仪器和性能的发展,LOD/LOQ水平正在下降。在SEDB中,LOD和LOQ值并不总是可用的,或者实验室报告了相同分析物的一系列值。由于分析性能不同,一些实验室报告的LOD/LOQ值与其他实验室报告的可量化浓度范围相同。因此,在本研究中,< LOQ/LOD值被排除在统计分析之外,尽管在视觉上被包含在图中(在线资源2;图S1-12),以免丢弃任何分析。为了能够生成达到痕量水平的化学品的时间趋势,需要具有低LOD/LOQ值的分析方法。
对新化学品的分析面临的一个挑战是缺乏分析标准。尽管非目标分析方法可以为我们提供一些化学结构信息,但需要一个分析标准来准确确认和定量(Schymanski et al. 2015)。然而,目前正在开发新的策略,在没有准确分析标准的情况下对化学品进行半量化,例如基于化学电离效率(Malm等人,2021)。新发现的危险化学品也需要高纯度的分析标准,以评估其潜在毒性。一项建议是,打算使用的生产者或进口商应在注册时提供先前未经测试的纯化学品或技术混合物。这将有助于监测“未来的”化学品和建立早期预警系统。
在首次尝试调查是否可以对SEDB中的OCs进行简化的风险评估时,使用了美国环保署的CompTox化学品仪表板来提取可用的毒性数据(Engelhardt et al. 2021)。在SEDB的166种OCs中,64%的OCs在CompTox化学仪表板中没有任何毒性数据(Engelhardt et al. 2021)。此外,SEDB中剩余36%的OCs的数据没有提供足够的细节来进行风险评估,至少从搜索容易获得的毒性数据来看是这样。两个数据库(欧洲食品安全局的OpenFoodTox和美国环保署的ECOTOX)提供了有关研究设计的更多信息,但报告的数据是外部给药剂量,无法使用(Engelhardt et al. 2021)。只有使用仍在开发中的通用PBTK模型才能将毒性数据与人类血液水平进行比较。MRA可用于识别造成风险最大的OC(或OC组)。将hbm - gv与瑞典普通人群每年血液中的平均浓度进行比较。在过去30年中,瑞典人群血液中ΣPCBs、HCB、PFOA和PFOS的浓度在某一时刻均高于hbm - gv(图9)。血液浓度一直在下降,目前均低于个人不良反应阈值。当使用hbm - gv时,即使涉及不同的目标端点,也可以通过将单个HQ汇总为混合HI来进行定性MRA (Bopp et al. 2019)。每个OC可产生多种不良反应,因此即使不良结局不是关键终点,也会产生混合效应。不同结果的OCs的综合风险估计很可能是保守的,并且高估了风险,因为只有具有相同不良结果的化学物质才能叠加起作用。一个重要的发现是,MRA中包含的9个OCs/ OCs组的综合风险表明,不能排除对一般人群产生不良影响的风险,因为2017年的HI为1.5。这表明需要进一步完善MRA,例如,通过考虑分组相似的结构和调查瑞典普通人群血液水平的变化。可以通过考虑,例如性别或年龄特定的群体,来研究这种变化,考虑浓度的年份和浓度范围的某些百分位数(EFSA等人,2021)。根据帕累托原理,可以预期只有少数oc对混合效应的大部分负责;在本研究中,驱动因素是全氟辛酸和全氟辛烷磺酸(Bopp et al. 2019)。全氟辛烷磺酸和全氟辛烷磺酸的HBM-GVs基于受体内和体外研究支持的流行病学研究,具有以下关键终点:生育力降低、胎儿生长、脂质代谢以及对免疫系统、性激素系统和甲状腺代谢的影响(Apel etal . 2017)。第三高的HQ是HCB,其HBM-GV相对较低(Aylward et al. 2010)。HBM-GV是基于大鼠和猪研究的肝毒性临界终点得出的(Aylward等,2010)。值得注意的是,本文中的总部是基于特定年份所有分析样本的平均浓度,并且应该考虑到血液中浓度较高的亚群。由于缺乏hbm - gv,只能对SEDB中一小部分oc和oc组进行MRA评估。考虑到我们暴露于众多的OCs,结果强调了获得更多hbm - gv和/或提供关于如何从血液中分析的化学混合物中估计混合风险的一般指导的重要性。
一些研究试图评估特定人群中特定影响的风险。SELMA研究使用流行病学数据和统计模型来发现可能的相关性(Bornehag et al. 2019)。他们在产前血液/尿液中发现了被称为“坏演员”的OCs,这与男孩的肛门生殖器距离较短有关。这些不良因素的混合物被编译并在体内测试,以找到一个出发点。可以看出,SELMA队列中13%的女性的浓度与较短的肛门生殖器距离有关。使用HI方法,只有3%的妇女有生育肛门生殖器距离较短的孩子的风险。结论是,只有使用HI的基于组件的MRA,风险可能被低估(Bornehag et al. 2019)。
考虑到化学品暴露的程度、缺乏毒性数据以及存在的混合物种类繁多,评估混合物风险仍然具有挑战性(Bopp et al. 2019)。由于普遍缺乏大部分新出现化学品的暴露数据,并且浓度随时间和空间而变化,因此我们无法对化学品暴露进行全面概述。根据我们在这项研究中收集到的信息,我们可以假设人体血液中暴露的化学物质(至少)包含440种OCs。假设人体血液污染物与总HI为1.5的9个oc /组oc的HQ分布相等,则440个oc对应的HI > 70。因此,估计的化学物质暴露水平可能是理论安全水平的70倍。这与Gennings等人的结论一致,即每种化学品的评估将化学混合物的风险低估了高达100倍(Gennings等人,2018)。
本研究创建的数据库将用于RiskMix (FORMAS)项目,其更高目标是进一步评估与人类相关的OCs暴露的综合风险。基于SEDB的与人类相关水平的复杂化学混合物已经被创造出来,并将在体内和体外测试混合物的毒性。SEDB和HBDB中列出的OCs已用于对甲状腺干扰特性的计算机预测(Dracheva et al. 2022)。
结论
在这项研究中,我们已经证明了对OCs的调节成功地导致了人类暴露量的减少。据我们所知,HBDB是目前人类血液中分析的最全面的人为OCs数据库。SEDB中对瑞典普通人群的暴露评估表明,血液中浓度最高的OCs组是PFASs,这也是用HI方法计算的综合风险的最大贡献者。我们希望这些数据库将有助于更好地了解OC暴露。此外,数据库还揭示了所研究的某些oc的知识差距。由于缺乏衍生的hbm - gv, MRA仅涵盖SEDB中的9个OCs/ OCs组。迫切需要推导出血液中相关OCs的HBM- gv,以便更好地利用HBM数据。值得关注的是,1.5的健康指数表明,即使只考虑这9种OCs和OCs组,也不能排除不利影响的风险,需要进一步改进评估。为了增加紧迫性,值得记住的是,在这项研究中,我们没有考虑对敏感群体或高暴露亚群体的影响。
补充信息
以下是电子补充材料的链接。
补充文件1 (XLSX 1896 kb)
补充文件2 (PDF 1268kb)
下载原文档:https://link.springer.com/content/pdf/10.1007/s12403-022-00507-y.pdf